2) jis k 0101工業用水試験法にキレート滴定が採用されている。 3) キレート滴定では金属とedtaが11のモル比で結合し、金属イオンの電荷数に関係しない。その為、標準溶液の濃度は規定濃度でなく モル濃度で表わす。キレート滴定の濃度計算問題についてです。 解き方がわからないので、教えていただきたいです。 以下、問題内容です。 Ca2とMg2の混合溶液(以下Aとする) mLをとキレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラル
容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量
キレート滴定 計算 濃度
キレート滴定 計算 濃度-ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。キレート滴定 1、目的 EDTAを用いるキレート滴定により、EDTAの濃度を求める。さらにそれを利用して濃度未知のCaCO3溶液の濃度を求める。 2、装置・器具・試薬 250mlメスフラスコ,250ml試薬びん,100mlメスシリンダー,10mlホールピペット,2ml駒込ピペット,0mlコニカルビーカー3個,ビュレット



比色試薬 金属指示薬 Pan 同仁化学研究所
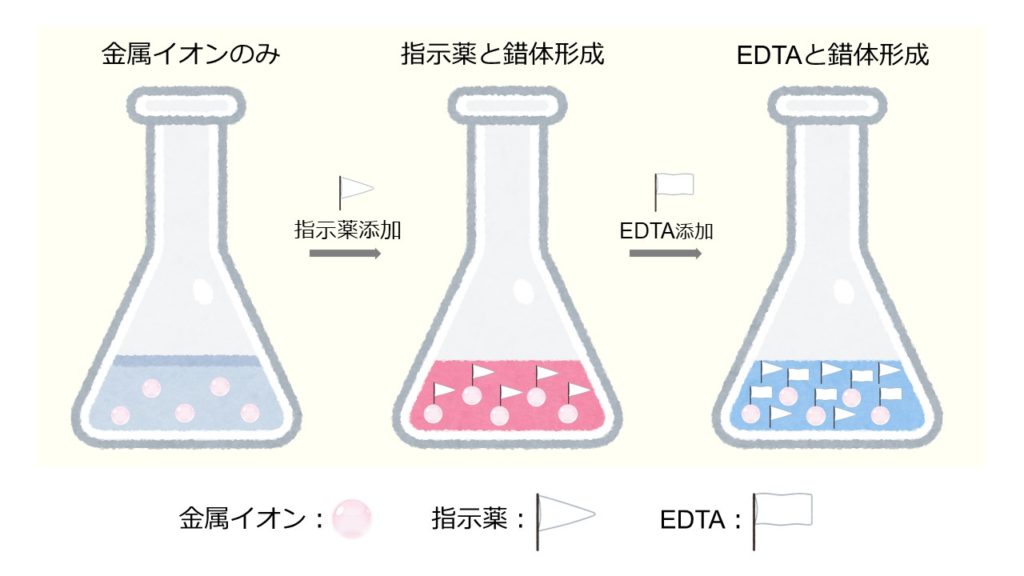
容量分析用標準液(濃度既知)を試料液(濃度未知)へ 少量ずつ加えて反応させる(= 滴定) →当量点 →標準液の体積から試料液中の成分量を計算する *化学反応の条件(教科書p38) 3 当量点: 反応が完結する理論上の点 終点: 実験的に判定した当量点計算式は次のようになります。 滴定曲線例 測定結果 滴定条件例 測定回数 試料量 滴定値 全ニッケル濃度 (mL) (mL) (g/L) 1 1 2 1 3 1 170 平均値 : 1124 g/L 統計計算 標準偏差 : 0376 g/L 変動係数 : 033 %Q キレート滴定の計算についてです。 キレート滴定の計算についてです。 ミネラルウォーターを001m edta標準溶液で滴定しました。 実験の結果から、カルシウムイオンとマグネシウムイオンの濃度の総和を求めよ。とのことなのですが、全くわかりません。
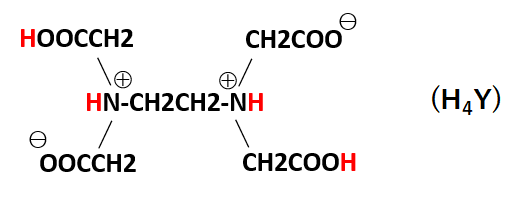
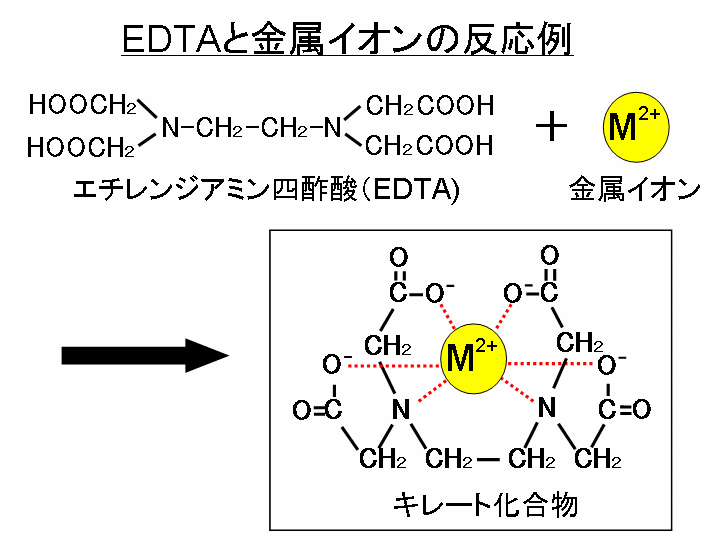
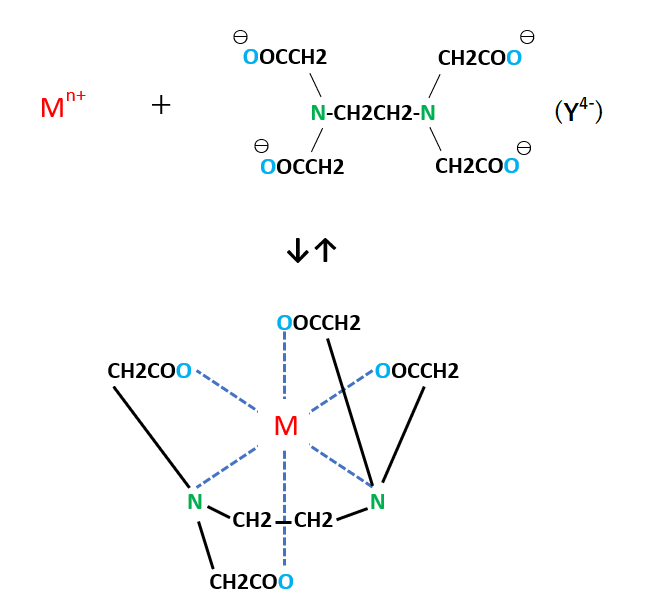
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数用いて、赤色から黄色に変化するまで滴定する。(キシレノールオレンジ指示薬でも、 色の変化は同じ) D Cu 2 濃度の計算 j) Cu 2 の滴定に必要なエチレンジアミン四酢酸二ナトリウム塩の量は、滴定 B と滴定 C の滴定量の差として計算される。となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが
用いて、赤色から黄色に変化するまで滴定する。(キシレノールオレンジ指示薬でも、 色の変化は同じ) D Cu 2 濃度の計算 j) Cu 2 の滴定に必要なエチレンジアミン四酢酸二ナトリウム塩の量は、滴定 B と滴定 C の滴定量の差として計算される。錯体・キレート平衡の計算問題 その1演習問題 このときの濃度は亜鉛イオンに制限され、Zn(NH3)4^2 = mol/L で、アンモニアの濃度はほぼ変化していないとみなし(近似し)005molのままと考えます。キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム ために、調製したedta溶液をZnの一次標準溶液で標定して、正確な濃度を求める。 5.滴定結果より、試料溶液250ml中に存在するniの重量を計算する。 4 4 置換滴定法



04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて
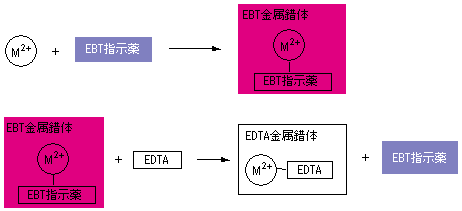
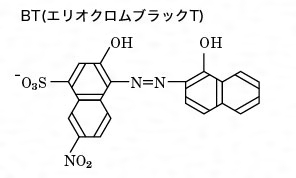
Q キレート滴定の計算についてです。 キレート滴定の計算についてです。 ミネラルウォーターを001m edta標準溶液で滴定しました。 実験の結果から、カルシウムイオンとマグネシウムイオンの濃度の総和を求めよ。とのことなのですが、全くわかりません。キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平衡)をキレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム ために、調製したedta溶液をZnの一次標準溶液で標定して、正確な濃度を求める。 5.滴定結果より、試料溶液250ml中に存在するniの重量を計算する。 4 4 置換滴定法


水の分析


水の硬度測定 キレート滴定
1 容量分析用標準液 キレート滴定では、標準液として下記のものが用いられる。 edtaは、1分子内に4個のカルボキシ基と2個の窒素原子を配位原子にもつ六座配位子であり、金属イオンと1:1で結合し、安キレート滴定,酸化還元滴定,沈殿滴定の四種類が挙げられる。 3.1.1 酸塩基滴定 酸塩基滴定は中和滴定とも呼ばれ,酸と塩基の中和反応に 基づく滴定方法で各種処理液の酸濃度,アルカリ濃度の分析 に用いる。例として,01 mol/L HCl 10 mL を01 mol/L NaOHキレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラル


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



号 疎水コロイドを用いた金属イオン濃度の簡易測定方法 Astamuse
質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法して酸性領域でEDTA によるキレート滴定によって定量します。 表示単位 T% M滴定液濃度 01 mol/L 滴加感度 0 mV スタートタイマ 5 秒 Fファクタ 1008 待ち時間 3 秒 連続滴加 mL 0 mL K係数1 5585 待ち感度 3 mV 統計計算 標準偏差 : 0168 g/L 0373 g/L 変動係数 : 0キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



アンモニア アミン類 配位結合 結合を形成する2つの原子の一方からのみ結合電子が分子軌道に提供される化学結合 Ppt Download
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数キレート滴定はキレート試薬を用いて金属イオンを定量する滴定法であり、錯滴定とも呼ばれる。 これは金属キレート化合物(金属多座配位子錯体)が安定であることを利用した滴定法である。 これに従うと、牛乳の密度をおよそ103 g cm3 として用いて、赤色から黄色に変化するまで滴定する。(キシレノールオレンジ指示薬でも、 色の変化は同じ) D Cu 2 濃度の計算 j) Cu 2 の滴定に必要なエチレンジアミン四酢酸二ナトリウム塩の量は、滴定 B と滴定 C の滴定量の差として計算される。


水の硬度測定



04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse
となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが動画は容量分析実験:キレート滴定で実習するMg 2 の定量を例にとって,その操作法を説明している EDTA (エチレンジアミン四酢酸)は,多くの金属イオンと安定なキレート錯体を作る. 指示薬には,金属イオンとキレート錯体を作ることにより,色が変化計算式は次のようになります。 滴定曲線例 測定結果 滴定条件例 測定回数 試料量 滴定値 全ニッケル濃度 (mL) (mL) (g/L) 1 1 2 1 3 1 170 平均値 : 1124 g/L 統計計算 標準偏差 : 0376 g/L 変動係数 : 033 %



ミネラル サプリ キレート 滴定


Ph指示薬変色範囲 お問合せ 試薬 富士フイルム和光純薬
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴点の判定などは,「化学基礎」で扱われている中和滴定の場合と同様であり,濃度や硬度の 計算,有効数字の扱い方などと併せ,しっかり身につけておいて欲しい事項である。 さて,この実験では,phが高い水溶液中ではmg2+ はoh-と反応してedtaと反応し
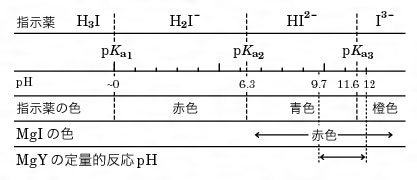


キレート滴定とは コトバンク



キレート滴定
キレート滴定 規格 1概要 メッキ液中のニッケルの定量は、試料に純水と緩衝液を加えた後、01mol/L EDTA溶液にて 滴定し、指示薬の変色により得られた滴定曲線上の変曲点を終点とします。 EDTA溶液の滴定量からニッケル濃度を算出します。 2参考文献正確な濃度がわかっているca2+標準溶液500 mlにkoh水溶液を加え,nnを指 示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定をキレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量
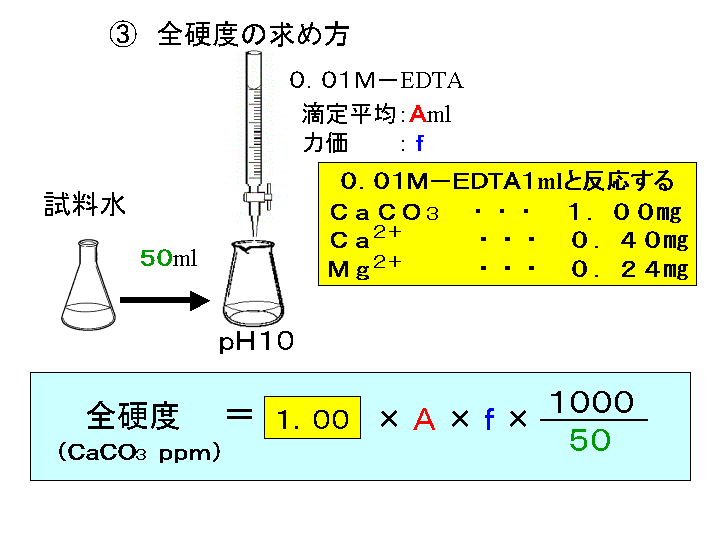


水の硬度測定 キレート滴定
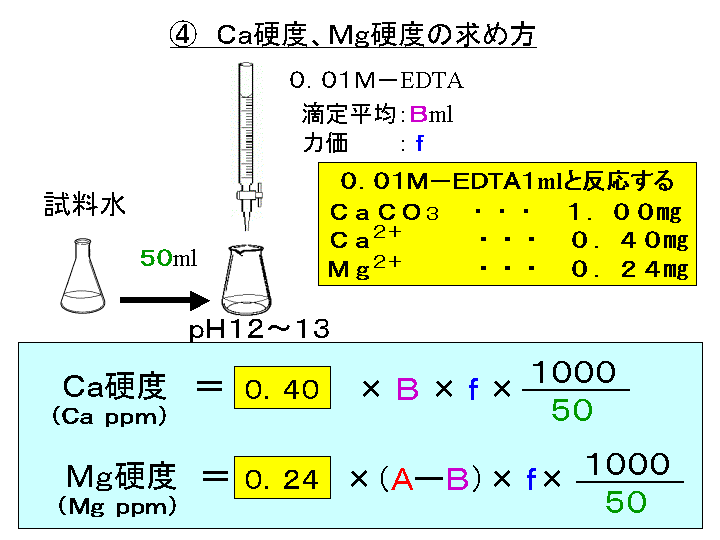


水の硬度測定 キレート滴定



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ



この文章から鉄イオンのモル濃度を求める事はできますか 溶液は25mlに 化学 教えて Goo



大学の 水の分析実験 なんとなく実験しています



キレート滴定 Yakugaku Lab


Microsoft Powerpoint 市工研発表資料 最終 配布用 Pptx Pdf Free Download



水の硬度測定 キレート滴定
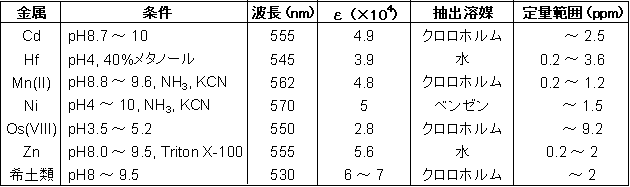


比色試薬 金属指示薬 Pan 同仁化学研究所



比色試薬 金属指示薬 Pan 同仁化学研究所


化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋



大分県立大分上野丘高校 19さが総文 みらいぶ 高校生サイト
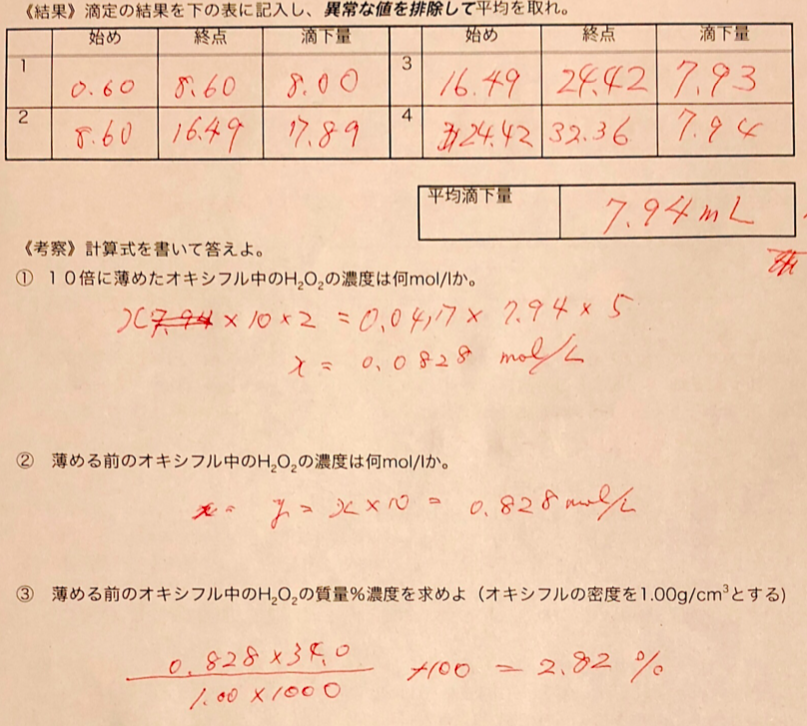


無料印刷可能 酸化 還元 滴定 考察 画像ブログ
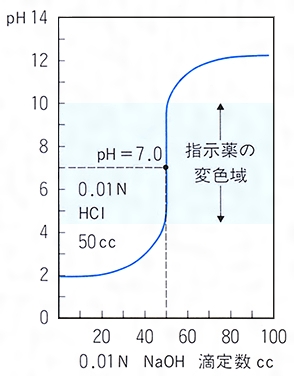


滴定とは コトバンク


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com



無料印刷可能 酸化 還元 滴定 考察 画像ブログ
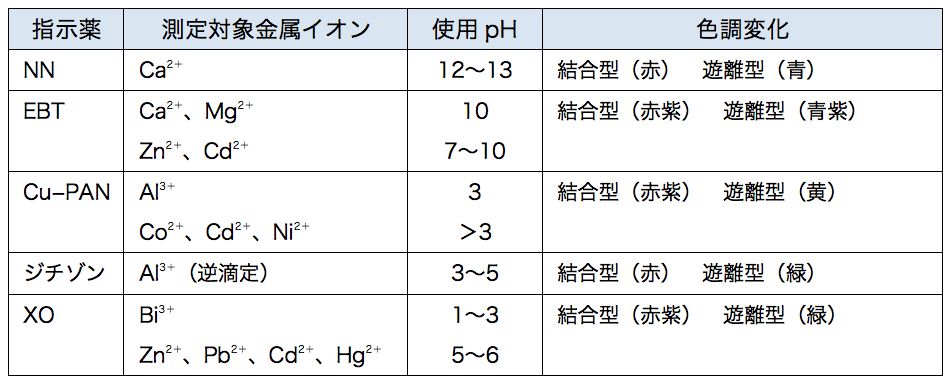


キレート滴定 Yakugaku Lab
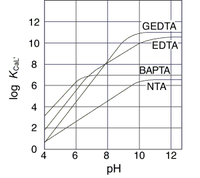


カルシウムキレート剤 脳科学辞典
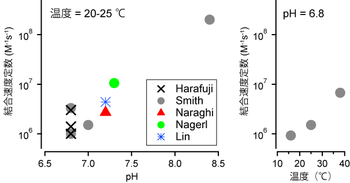


カルシウムキレート剤 脳科学辞典


水の硬度測定 キレート滴定



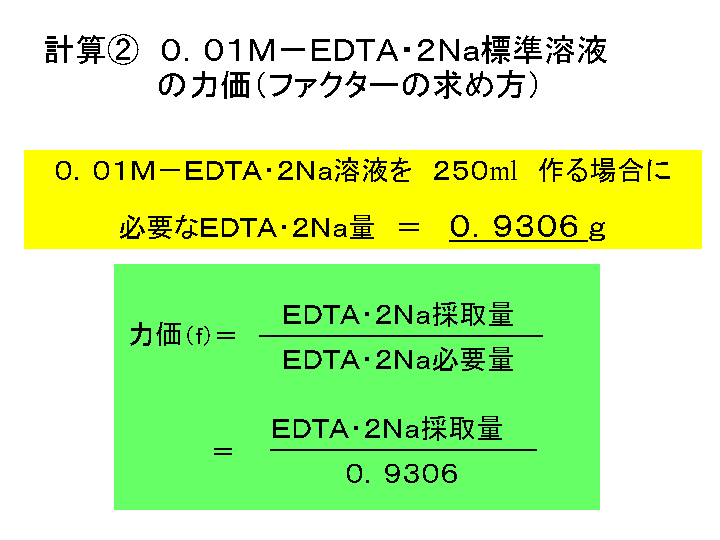
演習誰でもできる化学濃度計算 立屋敷 哲 著 紀伊國屋書店ウェブストア オンライン書店 本 雑誌の通販 電子書籍ストア
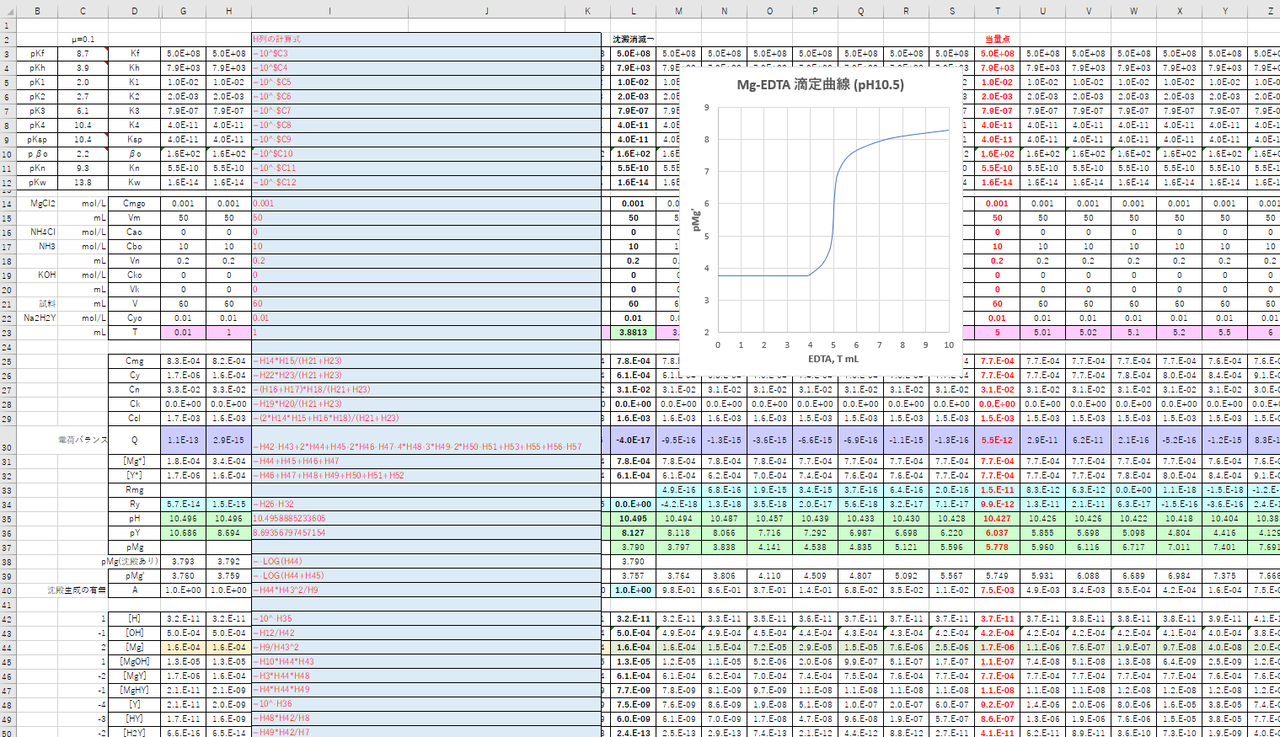


Edta 滴定曲線 溶解度などーエクセルを用いて
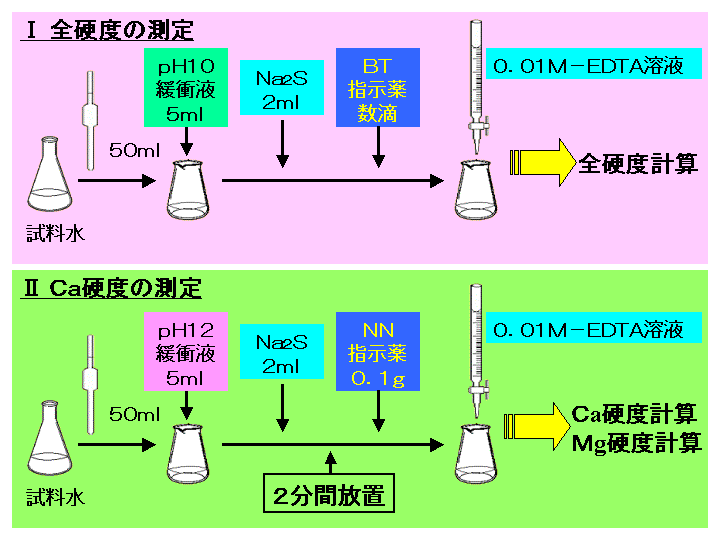


水の硬度測定 キレート滴定
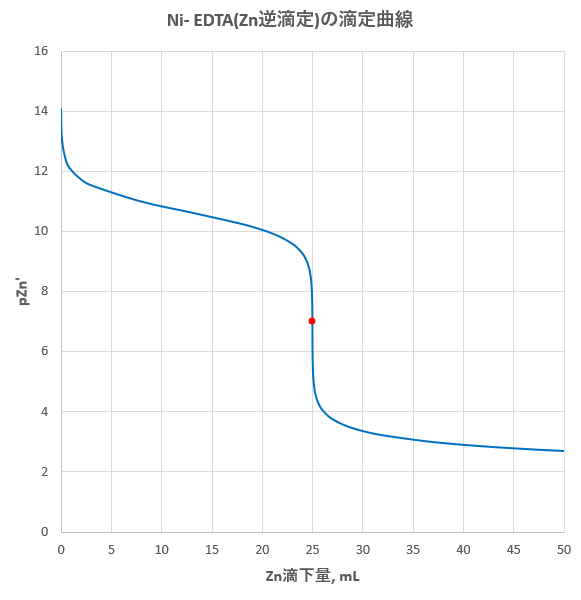


Edta 滴定曲線 溶解度などーエクセルを用いて


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋



分析実務たん Jis準拠 数式を書くのが面倒なので手書きで



逆滴定とは 行う理由 原理から例題を使った計算問題の解き方まで解説 化学のグルメ


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
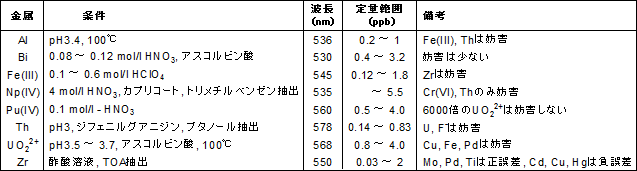


比色試薬 金属指示薬 Xo 同仁化学研究所



無料印刷可能 酸化 還元 滴定 考察 画像ブログ


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ



Dviout 酸と塩 Pdf 無料ダウンロード



キレート滴定
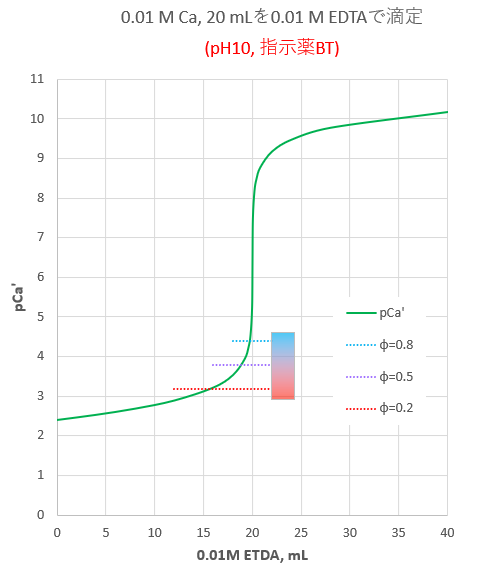


Edta 滴定曲線 溶解度などーエクセルを用いて



滴定 とは 意味 エキサイト辞書


質問箱



紫外 可視分光光度計による飲料中の鉄の濃度計算 Manualzz


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



書籍紹介 分析化学の基礎 木村 優 中島理一郎 共著 化学



04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ


分析化学キレート滴定 問濃度0 010mほca2 水溶液5 Yahoo 知恵袋


エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com



04 号 飛灰処理用液体キレート剤の必要添加量の決定方法 Astamuse



キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


キレート滴定とは コトバンク



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ


画像あり 水の全硬度を求める公式の導出方法を教えてください 0 0 Yahoo 知恵袋
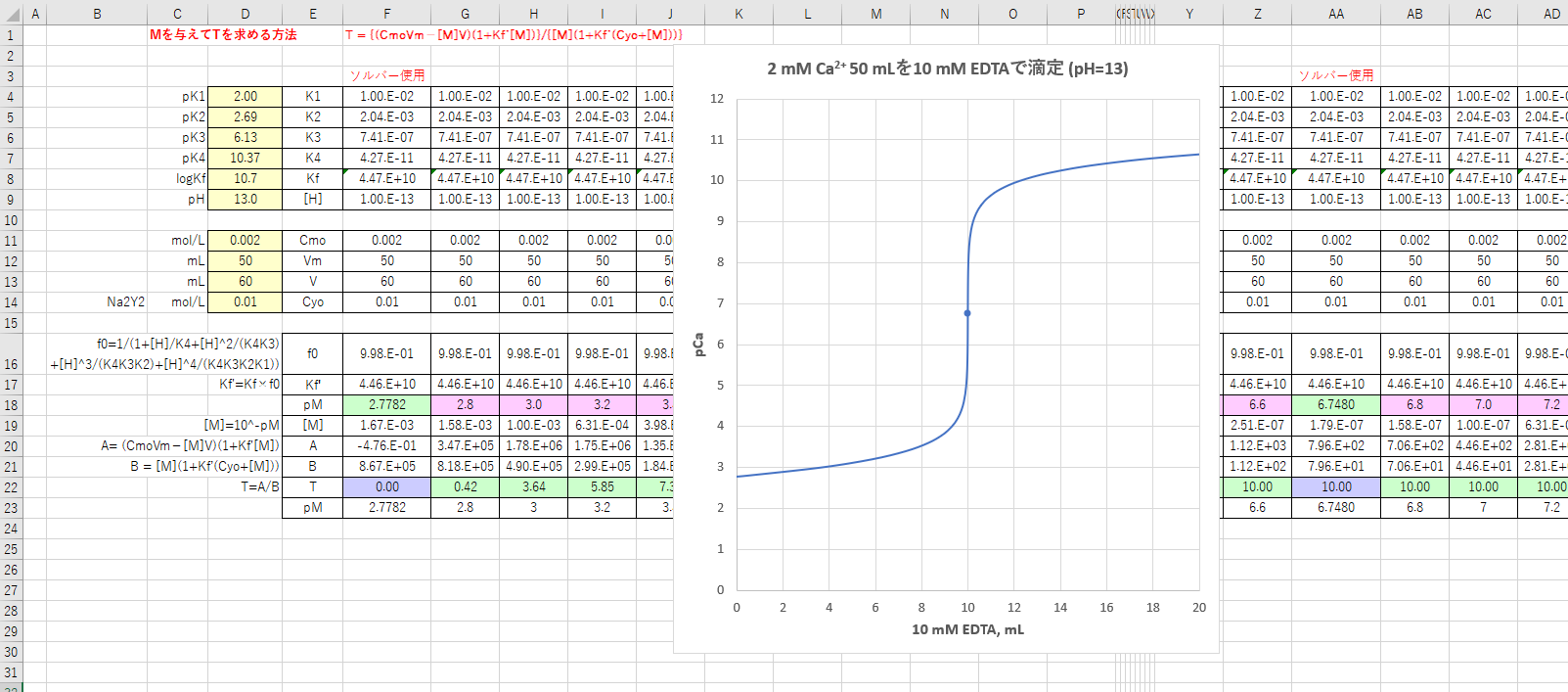


カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて


キレート滴定で緩衝液を入れすぎるとどうなるんでしょうか N Yahoo 知恵袋



0 件のコメント:
コメントを投稿